對于一些有著“遠大抱負”的病菌而言,掌握一些簡單但關鍵的物理知識必不可少。
鼠疫耶爾森菌(Yersinia pestis)是一種重寄生生物,它寄生于寄生在鼠類的跳蚤身上,十分擅長利用跳蚤在鼠類和人群中傳播。
它擁有的物理技巧是利用血液的回流感染新宿主。它們會在跳蚤的前胃處形成生物膜,將它們吸入的血液堵在那里。
這會讓跳蚤十分饑餓,只能繼續尋找宿主吸血,并在吸血時更用力。而這些新鮮的血液吸入時會撞擊堵塞的鼠疫耶爾森菌,混合著它們形成反流。
這會刺激跳蚤的“嘔吐反射”,它們會將部分血液帶著鼠疫耶爾森菌“嘔吐”出去,從叮咬的創口進入宿主體內。

引發鼠疫的鼠疫耶爾森菌 圖片來源:NIAID/NIH
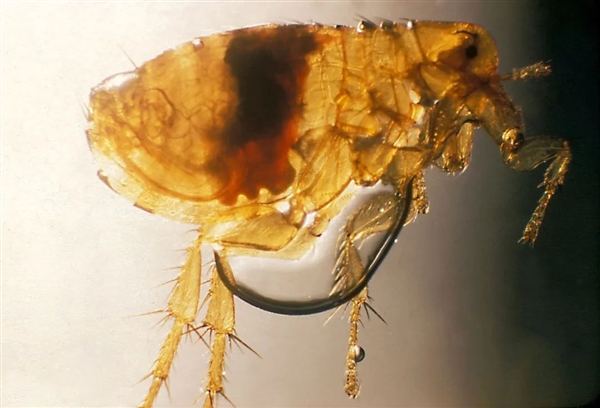
印度客蚤在吸食動物血液時,活的鼠疫耶爾森菌會進入它們的吸入食道,這些菌會繁殖并阻塞它們的前胃,最終迫使印度客蚤將受感染的血液反流到宿主體內。圖片來源:美國疾病控制與預防中心/維基百科
近年來,一些考古學研究發現,這種病菌從新石器時代晚期就開始感染人類,其高毒性的毒株首次出現于距今 3800 年前。
不過我們真正了解這種病菌的時間要晚得多:
人類直到經歷了慘痛的查士丁尼鼠疫(Plague of Justinian,即第一次鼠疫大流行,從 541 年到 549 年)和黑死病(即第二次鼠疫大流行的早期)之后,甚至到了第三次鼠疫大流行,才得知這些大流行的元兇都是鼠疫耶爾森菌。
3 次標志性的大流行
第三次鼠疫大流行開始于 1855 年。當時正是清朝的咸豐五年,鼠疫在云南地區暴發后開始擴散。
1894 年,廣州暴發鼠疫,導致約 8 萬人死亡,隨后香港又出現了嚴重的疫情。
不同于短時期暴發后就消失的疫情,鼠疫并沒有就此消散,而是在此后數十年內持續暴發,最終導致香港地區超 2 萬人死亡。
同一時期,鼠疫又隨著當時的全球航線蔓延到了世界各地,印度和中國的死亡最為慘重,累計數百萬甚至數千萬人。
哪怕是如今在烏干達、剛果、美國和蒙古等國出現的鼠疫,依然被認為是這次大疫情的遺留。
同樣是在 1894 年,日本的科學家北里柴三郎和瑞士裔法國細菌學家亞歷山大·耶爾森(Alexandre Yersin)分別到香港采集了病理樣本,并確認了鼠疫由鼠疫耶爾森菌引發。
4 年后,另一位法國醫生保羅-路易·西蒙德(Paul-Louis Simond)發現鼠疫之所以能從老鼠傳播給人類,離不開在受感染老鼠體表寄生的的印度客蚤(Xenopsylla cheopis)。
鼠疫在人群中的暴發,一般最先出現在人群密度大、衛生條件差,以及老鼠大量出沒的街區,而且一般是在老鼠快要死絕時——因為這個時候,鼠疫耶爾森菌需要新的宿主。
往前追溯,更早的兩次鼠疫大流行讓人類付出的代價似乎更加巨大,達到了顛覆經濟和文明發展的程度。
第一次鼠疫大流行持續了超過 2 個世紀,當時歐洲有一半的人都死于這次疫情。
第二次大流行則開始于至今都讓人們不寒而栗的黑死病(黑死病時期是從 1346 年到 1353 年),并持續了近 500 年的時間。
黑死病作為人類歷史上死亡人數最多的事件,席卷了歐洲、西亞和非洲。
據估計,當時歐洲人口的總體死亡率約為 30%以上,死亡人口約 2500 萬人。

法國馬蒂格的萬人坑中埋葬的鼠疫受害者。圖片來源:維基百科
鼠疫被稱為“黑死病”(the Black Death),更多是一種文學象征:“黑色”通常被用來描述死亡,而“黑死病”則深刻體現了鼠疫的急性致死性。
不過,這一描述也十分符合一部分感染者的遭遇。
敗血癥型鼠疫(Septicemic plague,鼠疫的3種感染形式之一)會導致彌漫性內血管凝血,患者會出現口腔、鼻子和腸道出血,皮下出血,四肢和組織壞死的情況,四肢和身體上出現大面積可怕的黑斑,而且死亡率接近 100%。
不過,這種情況相對少見。
更多患者感染的是腺鼠疫或肺鼠疫,但當這些感染發展得十分嚴重的時候——病菌會直接沖破淋巴結和肺部的阻礙,大量進入血液,也會快速引發敗血癥。
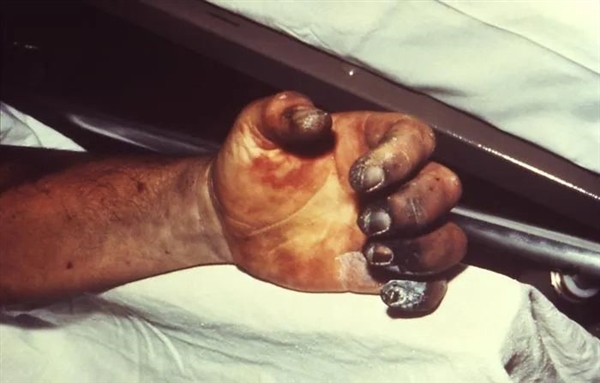
上圖的鼠疫感染者,左手出現壞疽,導致手指壞死。圖片來源于維基百科1
每次鼠疫大流行時,腺鼠疫都是最先出現且最主要的感染形式。
經由跳蚤叮咬,鼠疫耶爾森菌在進入人的皮膚后,會首先感染附近的淋巴,進而引起腺鼠疫。
除了發燒、嘔吐和疼痛等癥狀,患者身體多處的淋巴結會十分明顯地腫大,死亡率達 40%~60%。
肺鼠疫主要由腺鼠疫或者敗血癥型鼠疫(血液中的病菌也可以進入肺部造成感染)發展而來,也可能由患者直接吸入有病菌的飛沫引起。
患者會出現胸痛和咳血等癥狀,死亡率接近 100%。雖然不如敗血癥型鼠疫發展迅猛,但肺鼠疫卻極具傳播性。
一些研究發現,黑死病能在短短 5 年內造成數千萬人死亡,其原因或是發展出了人傳人的肺鼠疫。
隨著歷史上的疫情情況被逐漸復現,一些科學家開始將視線聚焦于一個新的問題:追溯每一次鼠疫耶爾森菌的來源,或者說在三次大疫情之間,這種病菌如何消退又興起。
今年 5 月 29 日,在一項發表于《科學》(Science)的研究中,法國巴斯德研究所和加拿大麥克馬斯特大學的研究人員合作發現,第一次和第二次鼠疫大流行中的病菌都來自嚙齒動物。
造成第一次大流行的病菌毒株沒有留下任何后代;不過,第二次大流行的毒株形成了兩個主要的演化分支:一支演化出了導致第三次大流行的菌株的祖先,另一支在幾個世紀內反復在整個歐洲暴發,最終于 19 世紀初滅絕。
鼠疫的興衰之謎
鼠疫耶爾森菌是一種球桿狀的細菌,無法運動,看起來單純、無害。
不過,它們可以形成抗吞噬的黏液層,進而通過宿主的“嘔吐”傳播。
該病菌的高致病性與其基因組上的一個致病島和體內的 3 種質粒密切相關。其中多個基因表達的蛋白質之間會協同合作,增強病菌的毒性、傳播性,幫助其躲避人體免疫,入侵并破壞人的淋巴結和肺部。
在《科學》的這項研究中,研究人員重點關注了其中 pPCP1 質粒上的 pla 基因。
pla 基因表達的蛋白質就像一把犀利的斧頭,能為鼠疫耶爾森菌“開路”。這種蛋白質可以將人和動物體內的纖溶酶原轉化為纖溶酶,而纖溶酶會降解人組織中的纖維蛋白和細胞外基質,讓病菌可以從皮膚擴散到淋巴結,引發腺鼠疫。
據一項 2015 年發表于《自然·通訊》(Nature Communications)的研究,pla基因也讓這種病菌可以在動物的肺中快速繁殖,導致致命的肺鼠疫。
麥克馬斯特大學的研究人員在分析了數百份古代鼠疫受害者的樣本后,有了一些特別的發現,那就是在第一次和第二次鼠疫大流行后期流行的病菌中,pla 基因的拷貝數均有所下降。
在第一次大流行中,有 30%的病菌出現了 pla 基因數量減少的現象,在第二次大流行中,這一比例為 51%。
這些發現顯示,似乎在大流行開始的數十年或一個世紀之后,就會開始出現 pla 基因減少的病菌毒株。
該論文的作者之一、麥克馬斯特大學古代 DNA 中心主任亨德里克·波伊納爾(Hendrik Poinar)提到:“這項研究是首批直接檢查古代病原體變化的研究之一,這種病原體我們至今仍能看到,我們試圖了解是什么導致了鼠疫大流行的毒性、持久性和最終的滅絕。”
為了驗證在古代毒株中的觀察,法國巴斯德研究所的研究者則測試了這家研究所收藏的、第三次鼠疫大流行的病菌樣本。
他們篩選了 2335 份現代病菌樣本,發現在野生病菌中,含 pla 基因的質粒數量可以多達 9 個,而在 pla 基因數量減少的病菌中,數量會下降到 1~2 個。
隨后,他們測試了不同 pla 基因缺失程度的病菌毒株感染小鼠的情況,包括 pla 基因數量減少了 90%的毒株,缺失數量處于中間水平以及未缺失 pla 基因的菌株。
研究顯示,后兩組菌株感染小鼠后,小鼠的死亡率為 100%,而第一組僅為 85%。而如果小鼠感染的菌株完全沒有 pla 基因,則死亡率則只有 7%。

圖片顯示鼠疫耶爾森菌在鼠疫大流行中,由于宿主種群數量的消退,從高致病性,到低致病性的轉變。圖片來源于論文
所以,其他的 pla 基因去了哪里呢?
研究人員進一步發現,pPCP1 質粒可以幫助 pla 基因整合到病菌的基因組中,在古老的毒株中似乎也有類似的情況。
這也解釋了為何古代和現代的鼠疫耶爾森菌樣本,都出現了質粒中 pla 基因數量減少的情況,而 pla 基因一旦整合到基因組中,就會無法發揮作用,宿主的死亡率就會降低,這也解釋了鼠疫的消亡。
一個殘忍的事實
結合這種病菌的傳播方式來看,它會主動降低自身的致命性,這似乎并不合理。
正如上文所言,鼠疫耶爾森菌的傳播,需要靠最初的宿主盡快到達接近死亡的嚴重敗血癥時期,這樣受感染的跳蚤會放棄舊宿主,尋找新宿主并傳播病菌。
而 pla 基因減少勢必會讓病菌的毒力減弱,宿主存活時間延長,進而降低總體的傳播率。
然而,之所以會出現這種看似不合理的現象,其原因其實存在于關于鼠疫時期的記載之中。
最初,高致死性的病菌確實會在鼠類中迅速且大規模地傳播,隨著鼠類大量死亡,病菌又會像颶風一樣劃過密集的居民區,收割人類的生命,并通過腺鼠疫和肺鼠疫快速傳播。
就像在黑死病期間,短短 5 年內,歐洲的人口數量一度減少了約 30%至 50%,而此后十年一次的鼠疫暴發,一直讓當時的人口數量維持在較低水平。
另一方面,在野生草原環境中,由于鼠疫,鼠類的死亡率也高達 95%以上。
在最初的一個世紀里,鼠疫不斷向感染的動物宿主和人類揮下鐮刀,就像篩子一樣濾過易感人群,而為了躲避死亡,宿主們也會日益分散。
在這樣的環境下,高毒性的病菌將無以為繼,因為它們殺死了舊宿主,又再也沒有了新宿主來填補傳播鏈條。
只有那些毒性更低的毒株才能潛伏在鼠群之中,等待鼠群和人群的數量再一次復蘇,方可以揮舞下一次的鐮刀。
在論文中,研究人員用流行病倦怠模型(models of epidemic burnout)解釋了這一現象:病原體不得不衰減到可以在小規模的種群中持續存在,以維持傳播,以便等種群恢復后,重新引發流行病。
慶幸的是,就在 1894 年,人類的命運出現了轉機。
科學家發現了鼠疫耶爾森菌,并進一步發現了它的傳播模式,并在后續的考古學研究中,進一步揭開了其身為前兩次鼠疫大流行的兇手身份。
這一切又推動了科學家開發治療鼠疫的方法,將人類從這個持續威脅數千年、殘酷且黑暗的死亡循環中解救了出來。
1943 年,美國微生物學家艾伯特·沙茨(Albert Schatz)和塞爾曼·瓦克斯曼(Selman Waksman)從灰色鏈霉菌中分離出了鏈霉素,這種化合物成為了首個治療鼠疫的藥物,其對 3 種鼠疫感染類型均有效。
在這之后,科學家又開發了一些副作用更小的抗生素,并開發了針對鼠疫的疫苗。
截至目前,雖然第三次鼠疫大流行的余燼仍在,但科學家還在開發更為前沿的 DNA 疫苗和病毒載體疫苗,以為人類提供更全面的保護。
參考文獻
[1]https://www.pasteur.fr/en/press-area/press-documents/plague-bacillus-became-less-virulent-prolonging-duration-two-major-pandemics
[2]https://www.nature.com/articles/ncomms8487
[3]https://en.wikipedia.org/wiki/Plague_of_Justinian
[4]https://www.britannica.com/event/Black-Death
[5]https://www.britannica.com/science/plague
[6]https://en.wikipedia.org/wiki/Black_Death
[7]https://www.who.int/en/news-room/fact-sheets/detail/plague
[8]https://www.eurekalert.org/news-releases/1085102
[9]https://www.science.org/doi/10.1126/science.adt3880
鄭重聲明:本文版權歸原作者所有,轉載文章僅為傳播更多信息之目的,如作者信息標記有誤,請第一時間聯系我們修改或刪除,多謝。



